Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Щавелевая кислота, формула, характеристики:
Щавелевая кислота (также – этандиовая кислота) – органическое вещество, относящееся к двухосновным предельным карбоновым кислотам.
Химическая формула щавелевой кислоты C2H2O4. Рациональная формула щавелевой кислоты HOOC−COOH либо (COOH)2. Изомеров не имеет.
Строение молекулы щавелевой кислоты:
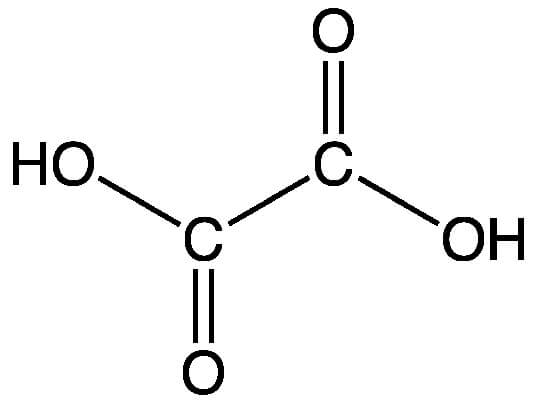
Щавелевая кислота (этандиовая кислота) – простейшая двухосновная кислота, первый член гомологического ряда двухосновных предельных карбоновых кислот.
Является сильной органической кислотой.
Щавелевая кислота по внешнему виду представляет собой бесцветные кристаллы. Имеет две кристаллические модификации: α – орторомбическая бипирамидальная (плотность 1,900 г/см3), β – моноклинная призматическая (плотность 1,895 г/см3).
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см3.
Хорошо растворяется в воде, неполностью – в диэтиловом и этиловом спирте, не растворяется в бензоле, хлороформе, петролейном эфире
Щавелевая кислота своё название получила из-за того, что образуется при щавелевокислом брожении. Впервые была получена в 1824 году немецким химиком Фридрихом Вёлером из дициана и воды.
В природе щавелевая кислота содержится в щавеле, ревене, кислице, карамболе и некоторых других растениях, а также в сырых овощах в свободном виде и в виде оксалатов калия и кальция.
Соли и сложные эфиры щавелевой кислоты называются оксалатами.
Название щавелевой кислоты на английском – oxalic acid.
Щавелевая кислота обладает токсическим действием, опасна для жизни и здоровья (опасность зависит от концентрации), обладает разъедающими свойствами.
Физические свойства щавелевой кислоты:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | без запаха |
| Вкус | кислый |
| Агрегатное состояние (при 25 °C и атмосферном давлении 1 атм.) | бесцветные кристаллы |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,9 |
| Плотность орторомбической бипирамидальной кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1900 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), г/см3 | 1,895 |
| Плотность моноклинной призматической кристаллической модификации (при 25 °C и атмосферном давлении 1 атм.), кг/м3 | 1895 |
| Температура плавления, °C | 189,5 |
| Температура самовоспламенения, °C | 518 |
| Константа диссоциации кислоты | 1,25; 4,14 |
| Удельная теплота сгорания, МДж/кг | 2,79 |
| Молярная масса, г/моль | 90,04 |
Химические свойства щавелевой кислоты:
Щавелевая кислота является сильной органической кислотой и проявляет кислотные свойства, характерные для карбоновых кислот.
Для нее характерны следующие химические реакции:
- реакция разложения щавелевой кислоты при нагревании:
C2H2O4 → CO + CO2 + H2O (to, kat = H2SO4 (конц.)).При нагревании с концентрированной серной кислотой разлагается на моноксид углерода (угарный газ), углекислый газ и воду. - реакция щавелевой кислоты c хлоратом калия:
C2H2O4 + 2KClO3 → K2CO3 + 2ClO2 + CO2 + H2O.Щавелевая кислота вступает в реакцию с хлоратом калия. В результате реакции образуется карбонат калия, диоксид хлора, углекислый газ и вода.Данная реакция используется для лабораторного синтеза диоксида хлора. - реакция щавелевой кислоты c раствором аммиака:
C2H2O4 + 2NH3 → (NH4)2C2O4.Щавелевая кислота вступает в реакцию с аммиаком, растворенном в воде. В результате реакции образуется оксалат аммония. - реакция щавелевой кислоты c йодом:
C2H2O4 + I2 → 2HI + 2CO2.Щавелевая кислота вступает в реакцию с йодом. В результате реакции образуется йодоводород и углекислый газ.Аналогичная реакция проистекает с хлором.Данные реакции применяют для получения йодоводорода и хлороводорода. - реакция щавелевой кислоты c карбонатом калия (или карбонатом натрия):
K2CO3 + H2C2O4 → K2C2O4 + CO2 + H2O,Na2CO3 + H2C2O4 → Na2C2O4 + CO2 + H2O.Щавелевая кислота вступает в реакцию с карбонатом калия (или карбонатом натрия). В результате реакции образуется оксалат калия (или оксалат натрия), углекислый газ и вода.Аналогичные реакции проистекают с карбонатом лития, карбонатом рубидия и карбонатом цезия. - 6. реакция диссоциации щавелевой кислоты в водном растворе:
H2C2O4 ↔ 2H+ + C2O42-.В водном растворе щавелевая кислота диссоциирует на ионы.
Получение щавелевой кислоты:
Щавелевую кислоту получают:
- окислением углеводов, спиртов и гликолей смесью азотной и серной кислот в присутствии оксида ванадия (V2O5);
- окислением этилена и ацетилена азотной кислотой в присутствии хлорида палладия (PdCl2) или нитрата палладия (Pd(NO3)2);
- окислением пропилена жидким оксидом азота (NO2);
- из формиата натрия.
Безопасность при обращении с щавелевой кислотой. Требования ГОСТ:
Щавелевая кислота – сильная органическая кислота, в больших количествах может вызывать раздражение слизистых оболочек пищевода, желудка, кишечника, дыхательных путей и кожных покровов.
Предельно допустимая концентрация щавелевой кислоты в воде водных объектов хозяйственно-питьевого и культурно-бытового общепользования – 0,5 мг/дм3., лимитирующий показатель вредности – общесанитарный. (см. ГОСТ 22180-76 Реактивы. Кислота щавелевая. Технические условия (с Изменениями N 1, 2)).
При работе с щавелевой кислотой следует применять индивидуальные средства защиты (респираторы типа “Лепесток” по ГОСТ 12.4.028, защитные очки по ГОСТ 12.4.013, резиновые перчатки по ГОСТ 20010), а также соблюдать правила личной гигиены.
Помещения, в которых проводятся работы с препаратом, должны быть оборудованы непрерывно действующей приточно-вытяжной вентиляцией. Анализ препарата следует проводить в вытяжном шкафу лаборатории.
Щавелевая кислота – горючее вещество. Температура самовоспламенения в слое 518 °С. Для пылевоздушной смеси нижний концентрационный предел воспламенения – 205 г/см3. Средствами пожаротушения являются тонкораспыленная вода, химическая и воздушно-механические пены.
Применение щавелевой кислоты:
Щавелевая кислота применяется:
- в текстильной и кожевенной промышленности как протрава, при покраске шелка и шерсти,
- в металлургии для чистки металлов от коррозии, оксидов, накипи, ржавчины,
- в пчеловодстве для обработки пчел,
- в бытовой химии в качестве средства для удаления ржавчины, моющих, отбеливающих и дезинфицирующих средств,
- в медицине и фармакологии
- в аналитической и органической химии в качестве реагента и для осаждения редкоземельных элементов.



























